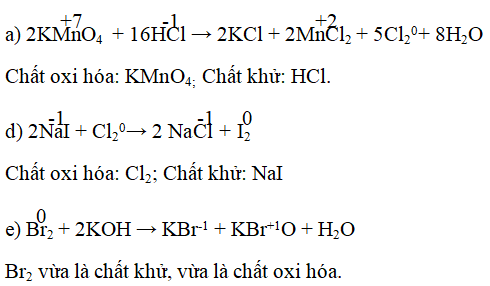Hóa học, một lĩnh vực đầy kỳ diệu và thú vị, đôi khi mang đến những điều đặc biệt. Trong thế giới hóa học, hầu hết các nguyên tố hoặc hợp chất đều chỉ có tính oxi hóa hoặc tính khử. Tuy nhiên, có một vài chất đặc biệt, vừa có tính oxi hóa vừa có tính khử. Bài viết này sẽ giúp bạn tìm hiểu về chủ đề hóa học độc đáo này.
TÓM TẮT
Các chất vừa có tính oxi hóa vừa có tính khử là gì?
Dưới đây là danh sách các hợp chất có tính oxi hóa và tính khử: Ví dụ như H2O, H2O2 (hydrogen peroxide), SO2 (lưu huỳnh đioxit), HNO2, H2SO3, NaNO2, Na2SO3…
Bài viết tiếp theo sẽ đi vào chi tiết về một số chất có tính oxi hóa và tính khử phổ biến.
Nước – H2O
Nước là một chất đặc biệt, vừa có tính oxi hóa vừa có tính khử trong nhiều phản ứng hóa học khác nhau. Nước có thể thực hiện cả hai vai trò này nhờ sự tương tác với các chất hóa học khác.
Tính oxi hóa của nước:
Nhiều nguyên tố hóa học như Flo (F) có tính oxi hóa mạnh và có thể oxi hóa nước thành oxi nguyên tử và axit Flohydric (HF).
4F + 2H2O → 4HF + O2
Tính khử của nước:
Các kim loại hoạt động mạnh như Liti (Li), Natri (Na), Kali (K) có thể khử nước thành hydro dễ dàng. Kết quả là tạo ra dung dịch bazơ và khí Hiđro.
2Li + 2H2O → 2LiOH + H2
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Như vậy, nước có thể hoạt động như trong các phản ứng axit-bazơ, đồng thời là một chất lưỡng tính. Được biết, khi có mặt chất khử mạnh, nước đóng vai trò là chất oxi hóa, trong khi có mặt chất oxi hóa mạnh, nước đóng vai trò là chất khử.
Tuy nhiên, nước chỉ có tính oxi hóa và tính khử yếu, do đó không có nhiều chất khử hoặc oxi hóa nó. Tuy vậy, nó lại là một dung môi tốt cho các phản ứng oxi hóa khử.
H2O2
Hydrogen peroxide hay còn gọi là nước oxy già cũng là một chất đặc biệt, có tính oxi hóa và tính khử. Oxi trong H2O2 tồn tại ở trạng thái oxi hóa -1, cho phép nó tham gia cả hai phản ứng oxi hóa và khử.
Tính oxi hóa của H2O2:
H2O2 có thể bị oxi hóa bởi hợp chất thuốc tím KMnO4.
2KMnO4 + H2O2 → 2MnO2 + 2O2 + 2KOH
Hoặc H2O2 có thể oxi hóa sắt II lên sắt III.
2FeCl2 + H2O2 + 2HCl → 2FeCl3 + 2H2O
Tính khử của H2O2:
H2O2 có thể bị khử thành O2 và nước.
2H2O2 → O2 + 2H2O
H2O2 có tính oxi hóa mạnh hơn tính khử, đặc biệt là trong các dung dịch axit.
4KMnO4 + 4H2O2 + 6H2SO4 → 3O2 + 4MnSO4 + 2K2SO4 + 2H2O
SO2 (lưu huỳnh đioxit)
Lưu huỳnh đioxit (SO2) là một hợp chất đặc biệt khác, trong đó nguyên tố lưu huỳnh có số oxi hóa +4, là số oxi hóa trung gian giữa các số oxi hóa -2 và +6. Vì vậy, SO2 có thể tham gia cả phản ứng oxi hóa và phản ứng khử.
Tính khử của SO2:
SO2 có thể tác dụng với các chất oxi hóa mạnh như nhóm halogen và thuốc tím KMnO4.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Tính oxi hóa của SO2:
Lưu huỳnh đioxit có tính oxi hóa khi tác dụng với các chất khử mạnh hơn như H2S, Mg…
SO2 + H2S → S + H2O
SO2 + Mg → S + MgO
Những hợp chất khác có tính oxi hóa và tính khử
Ngoài những hợp chất nổi tiếng như nước, H2O2 và SO2, còn có một số hợp chất khác vừa có tính oxi hóa vừa có tính khử như HNO2, H2SO3, NaNO2, Na2SO3…
Kết luận
Một số chất đặc biệt trong hóa học có thể vừa có tính oxi hóa vừa có tính khử. Điều này thể hiện sự đa dạng và phức tạp của các phản ứng hóa học. Nếu một nguyên tố ở trạng thái oxi hóa trung gian trong một hợp chất, hợp chất đó có thể đóng vai trò vừa là chất oxi hóa vừa là chất khử.
Qua bài viết này, bạn đã có câu trả lời cho câu hỏi: “Các chất có tính oxi hóa vừa có tính khử là những chất gì?”. Hy vọng bạn đã tìm thấy kiến thức hữu ích. Để có thêm thông tin về hóa học và ứng dụng của nó, hãy ghé thăm trang web VDO Software.
Trang chủ: tmdl.edu.vn – Danh mục bài: Công thức Hóa Học